
Mitochondriale ß-oxidatie in humane fibroblasten.
Tijdens perioden van vasten vormen vetzuren de belangrijkste bron voor energieproduktie via oxidatie in de lever, de hartspier en de skeletspieren. Vetzuren worden gemobiliseerd uit voorraden in de vetweefsels, en vervolgens via de bloedbaan (voornamelijk aan albumine gebonden) getransporteerd. Via concentratie-afhankelijke mechanismen worden de vetzuren in de lever en andere weefsels opgenomen. Eenmaal in de cel vormen vetzuren met behulp van acyl-CoA-synthase, CoenzymA-esters. Om de mitochondriële membraan te kunnen passeren, moeten langketen-acyl-CoA-esters eerst getransesterificeerd worden aan carnitine, zodat acylcarnitines ontstaan. Dit gebeurt met behulp van het enzym Carnitine Palmityl Transferase (CPT I). Het transmembraantransport van acylcarnitines vindt plaats met behulp van Carnitine Translocase. Binnen de mitochondriële matrix worden acylcarnitines teruggevormd tot CoA-esters door het enzym Carnitine Palmityl Transferase II (CPT II). Midden-keten en kort-keten vetzuren kunnen de mitochondriële membraan als vrije zuren passeren, en worden dus niet aan carnitine gebonden. Eenmaal in de mitochondriën worden ze geactiveerd tot acyl-CoA-vetzuren.
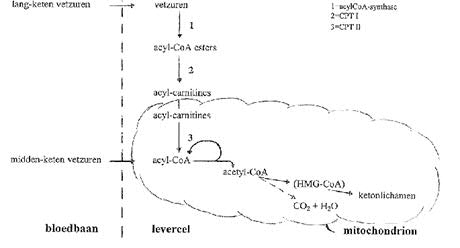
Vetzuren treden in de vorm van acyl-CoA-esters de mitochondriële ß-oxidatie binnen.Bij elke ‘ronde’ van de ß-oxidatie-spiraal, komt er acetyl-CoA vrij, en wordt de ketenlengte van een verzadigde acyl-CoA-ester verkort met twee koolstofatomen. In de meeste weefsels, zoals hart en spieren, wordt acetyl-CoA via de citroenzuurcyclus geoxideerd tot koolstofdioxide en water. In de lever, en in mindere mate in de nieren, wordt acetyl-CoA dat afkomstig is van de ß-oxidatie, grotendeels omgezet in ketonlichamen via de hydroxymethyl-glutaryl-CoA (HMG-CoA) route. Deze ketonlichamen worden vervolgens afgevoerd voor oxidatie door andere weefsels, zoals de hersenen.
Acyl-CoA esters kunnen net zo vaak de ß-oxidatie spiraal doorlopen als er acetyl-CoA fragmenten kunnen worden gevormd (vb: palmitoyl-CoA kan de spiraal zeven keer doorlopen).
Elke ronde van de ß-oxidatie spiraal wordt doorlopen met behulp van een aantal enzymen.
Voor een verzadigd acyl-CoA ester spelen de volgende enzymen een rol:
- Acyl-CoA dehydrogenase
- Enoyl-CoA hydratase
- ß Hydroxyacyl-CoA dehydrogenase
- ß ketoacyl-CoA thiolase
Er zijn drie acyl-CoA dehydrogenase-enzymen bekend, die ieder een verschillende ketenlengte-specificiteit bezitten. Zo katalyseert LCAD (Long Chain Acyl-CoA Dehydrogenase) de eerste ß-oxidatie-stap voor acyl-CoA esters met een ketenlengte variërend van 18 tot 12 koolstofatomen. MCAD herkent de acyl-CoA esters met een ketenlengte variërend van 14 tot 4 koolstofatomen, en SCAD herkent alleen de C4 - en C6- acyl-CoA esters.
Men vermoedt dat er ook ketenlengte-specifieke enoyl-CoA hydratases, ß hydroxyacyl-CoA dehydrogenases en ß ketoacyl-CoA thiolases bestaan. Acyl-CoA esters met een oneven ketenlengte worden door dezelfde serie reakties als hierboven beschreven geoxideerd, tòt propionyl-CoA is gevormd. Propionyl-CoA wordt afgebroken door het biotine-afhankelijke enzym propionyl-CoA carboxylase. Onverzadigde acyl-CoA esters worden ook door dezelfde serie reakties geoxideerd, totdat de dubbele binding bereikt is. Voor verdere oxidatie zijn in dit geval twee extra enzymen nodig, te weten 3cis, 2trans-enoyl-CoA isomerase en 2,4-diënoyl-CoA reductase.
Principe:
Met behulp van deze enzym assay wordt de over-all ß-oxidatie gemeten in fibroblasten.Hiertoe worden fibroblasten geïncubeerd met twee verschillende vetzuursubstraten, te weten myristinezuur en palmitinezuur.Beide vetzuren zijn op het 9e en 10e koolstofatoom radio-aktief gelabeld (3H);Voordat deze zuren de ß-oxidatie ingaan, worden ze mbv acylCoA-synthase en CPT I en CPT II omgezet in acyl-CoA esters en de mitochondriën binnengesluisd.
Myristoyl-CoA (C14):
O
C - C - C - C - C* - C* - C - C - C - C - C - C - C - C - S - CoA
Palmitoyl-CoA (C16):
O
C - C - C - C - C - C - C* - C* - C - C - C - C - C - C - C - C - S - CoA
Bij elke ronde van de ß-oxidatie spiraal wordt er een acetyl-CoA van de keten afgesplitst.
Normaalgesproken zal myristoyl-CoA dus zes keer, en palmitoyl-CoA zeven keer de ß-oxidatie spiraal doorlopen. Bij beide CoA-esters zal na de vijfde cyclus de radio-aktiviteit worden afgesplitst in de vorm van een gelabeld acetyl-CoA. De radio-aktiviteit wordt vervolgens overgedragen op water. Wanneer het reaktiemengsel over een Dowex kolom wordt geleid, zullen niet volledig geoxideerde CoA-esters op de kolom blijven hangen; j 3Hk -H2O wordt wèl geëlueerd. Normaal gesproken zal men de radio-aktiviteit dus grotendeels terugvinden in het eluaat.
Is er echter sprake van bijvoorbeeld MCADD, een enzymdefekt waardoor CoA-esters maximaal tot een ketenlengte van zes koolstofatomen geoxideerd kunnen worden, dan is dit niet het geval:
Incubatie met myristinezuur geeft dan uiteindelijk hexanoylCoA-esters die radioaktiviteit bevatten, incubatie met palmitinezuur geeft hexanoylCoA-esters die geen radioaktiviteit bevatten. In het myristinezuur-eluaat zal men dus een verlaagde aktiviteit vinden. Bij andere defekten (CPT I / CPT II / LCAD) zal men in zowel het myristinezuur-eluaat als in het palmitinezuur-eluaat een verlaagde aktiviteit vinden. De radio-aktiviteit die gevonden wordt in de myristinezuur- en palmitinezuur eluaten geeft een aanwijzing òf, en zo ja, wààr er een defekt is in de overall- ß-oxidatie.
Benodigd materiaal: fibroblasten
Referenties:
- Roe CR, Ding J, Mitochondrial Fatty Acid Oxidation Disorders. In:Scriver CR, Beaudet AL, Sly WS, Valle D, eds.The Metabolic and Molecular Bases of Inherited Disease. 2001; 8 edtion: 2297-2327
| Last modified: | 23 February 2015 4.54 p.m. |
